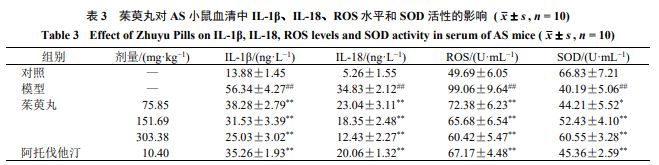

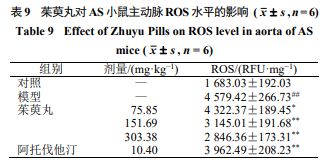
如表9 所示,与对照组比较,模型组小鼠主动脉ROS 水平明显增加( P <0.01 );与模型组比较,给给药组ROS 水平均显著降低( P <0.05 、0.01 )★★◆◆。
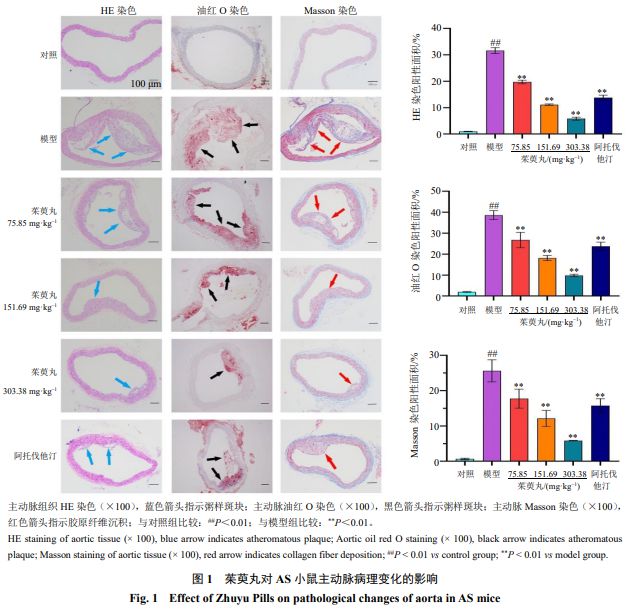
如图1 所示■★■,对照组小鼠主动脉可见血管壁各个层次排列整齐,结构清晰◆■◆,少见皱褶及空泡◆■,几乎无红染及胶原着色◆★★★★。与对照组比较,模型组主动 脉内膜大面积增厚■■◆◆◆,脂质斑块增多沉积★■★◆★◆,结构模糊化并形成明显的泡沫细胞,大量褶皱及空泡,大片红染形成,部分区域形成特征性 AS 斑块,斑块有较大范围的胶原蛋白沉积★◆■◆■■。与模型组比较,各给药组主动脉斑块及血管壁泡沫细胞均呈现不同程度的改善,胶原纤维增加减少,随着茱萸丸剂量的增加,上述病变程度随之减轻。
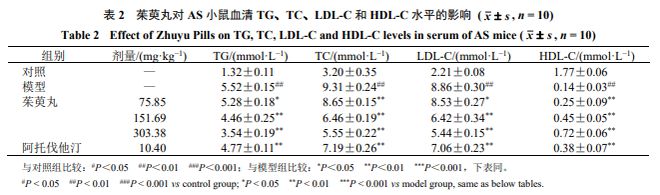
末次给药后12 h 禁食不禁水,摘眼球取血。室温静置2 h ,4 ℃■★◆★■、12 000 r/min 离心15 min ★★■■■,收集上层血清。按照试剂盒说明书操作,采用全自动生化分析仪检测各组小鼠血清中TC 、TG 、LDL-C 、HDL-C 水平。
2.8.3PCR 产物电泳检测和纯化 1% 琼脂糖凝胶电泳检测扩增目的条带大小■■◆◆★,使用磁珠法进行自动化纯化。
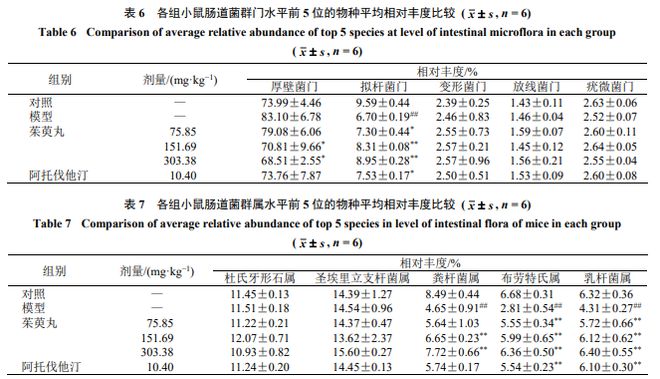
3.5.2 门水平菌群丰度及差异 门水平上各组小鼠菌群优势种类差异不大,主要由厚壁菌门★■、拟杆菌门等构成。如表6 所示★■★,与对照组比较,模型组拟杆菌门菌群丰度明显降低( P <0.01 )◆◆;与模型组比较,各给药组拟杆菌门菌群丰度显著上升( P <0.05 、0.01 ),茱萸丸中■■◆◆◆、高剂量组厚壁菌门菌群丰度显著下降( P <0★◆◆◆.05 )。
每组取3 只小鼠主动脉组织进行蛋白提取◆◆◆,使用BCA 测定各组总蛋白浓度,蛋白样品经十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳,转至PVDF 膜,分别加入TXNIP (1 ∶1 000 )、NLRP3 (1 ∶1 000 )、GAPDH (1 ∶5 000 )一抗,4 ℃摇床孵育过夜◆★;加入二抗(1 ∶10 000 )◆■◆■★◆,4 ℃摇床孵育2 h ,显影曝光■★◆★,使用ImageJ 1★★.44 软件对条带进行分析。
动脉粥样硬化(atherosclerosis★◆◆■★,AS)是动脉内膜的脂质、血液成分沉积★★,平滑肌细胞及胶原纤维增生,伴有坏死及钙化等不同程度病变的慢性进行性病理过程[1]★★★。流行病学研究显示,在我国有超过3★■◆★.3亿的心血管病患者,且导致的死亡人数占全球死亡人数的1/3◆■◆◆,而AS就是导致心血管疾病的最主要原因[2]。目前治疗AS的药物主要针对脂质代谢和血小板活化途径,如他汀类和阿司匹林等[3],治疗效果有限★■■★,并能引发细胞损伤、肝肾损伤及肌病等不良反应[4]。肠道菌群与AS之间有密切联系,调节肠道菌群稳态已成为防治AS新靶点。研究表明,氧化三甲胺(trimethylamine oxide,TMAO)作为肠道菌群衍生的代谢产物◆■,是炎症调控的关键因子■◆★★◆★,可增加炎症因子释放或激活相关炎症通路◆■★◆,促进泡沫细胞在血管内沉积[5]。TMAO升高会导致大量活性氧簇(reactive oxygen species◆★◆★,ROS)的生成◆★,过量的ROS诱导硫氧还蛋白相互作用蛋白(thioredoxin interacting protein,TXNIP)从硫氧还蛋白(thioredoxin,TRX)中解离。TXNIP降低TRX的ROS清除能力并与核苷酸结合寡聚化结构域样受体蛋白(NOD like receptor family pyrin domain containing 3,NLRP3)结合,介导NLRP3炎症小体与凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和半胱氨酸天冬氨酸蛋白酶-3前体(pro-cystein-asparate protease-3,pro-Caspase-3)的组装◆◆。随后Caspase-1的自切割和激活反过来导致白细胞介素-1β前体(pro-interleukin-1β,pro-IL-1β)和pro-IL-18加工成其成熟形式,然后诱导其他促炎基因的表达,引发氧化应激和炎症反应■◆■■■,促进AS形成[6]。

AS 病在血脉,根在脏腑◆★■■◆★,脾失健运,水津不布,精化为浊,导致膏脂运化输布障碍,湿浊内生,输于血脉,成为“浊脂■★”,壅积脉道■■◆,浸淫脉络,着而不去,脉络与痰瘀相搏,结聚成块,正如《证治汇补》所言■★■■“脾虚不运清浊,停滞津液而为痰生” [16] ◆★◆■★★。国医大师阮士怡 [17] 将AS 斑块与积病概念结合★★◆◆◆■,创新性提出“脉中积”概念,该病名不仅体现出沉积于血脉的发病位置,还概括 了“脾胃壅遏,浊伏于脉”的病理机制,兼具中医特色。脾胃为水谷精微转 运之枢纽,气虚于内,周流不畅,则陈气、血浊蓄积,浊邪沉积于脉壁★◆■,形成有形■★、固定不移之斑块■◆■★,发为AS。治脾之剂以升运为要,调胃之力以降泄为先,脾胃并理,自当两法并取,故选择辛味药能开能通,苦味药可降可泄,辛苦相合,升降同施■■◆★■,藉以助脾散精,导浊下行★◆■,清除脉壁浊邪★◆★■★,从而脉道通畅◆■,无斑块闭阻之碍■◆。茱萸丸由黄连★■■◆■◆、吴茱萸组成,二者一辛一苦、一升一降★◆■■,是辛开苦降的代表组合★■。该治法将辛热与苦寒2种药性相反的药物置于一方之中,彼此相互为用又互相佐制★★◆■★★,是一种具有双向调节功能的典型中医特色的用药方法[18]。《素问·至真要大论》 中记载:“阳明之复,治以辛温,佐以苦甘,以苦泄之,以苦下之■★”,揭示了辛与苦 2 类不同性质的药物具有协同作用,可以合理配伍。清代叶天士将辛开苦降法作为一个治则提出,其在《临证指南医案》中提出“辛以开之◆◆★,苦以降之”的论点◆◆■◆★,认为辛苦合用则★◆“苦能驱热除湿,辛能开气宣浊■■★”[19]。总之,茱萸丸通过辛开苦降治法健中助运■★■■,调畅气机,导浊下行★★★◆★,充分发挥◆★★■“气行-津行-脂行”之效,以此防治AS◆★。
采用总RNA 提取试剂盒提取主动脉组织中总RNA ■★■■,采用超微量紫外分光光度计测定RNA 浓度。采用iScript™ cDNA 合成试剂盒将RNA 逆转录为模板cDNA 。采用Sso Advanced TM Universal SYBR ®Green Supermix 试剂盒进行qPCR 反应。反应条件设置为95 ℃预变性30 s ◆■◆★◆,95 ℃变性5 s ◆★◆,60 ℃退火30 s ■■■★■◆,40 个循环■◆★,收集荧光信号◆■◆◆■,结果采用2 −ΔΔCt 计算mRNA 的相对表达量。引物由生工生物工程(上海)股份有限公司设计合成,引物序列见表1 ◆■◆■■■。
LDLR −/− 小鼠是 AS 研究的经典动物模型★★◆◆■,可在自然膳食的情况下形成严重的高脂血症■★★■■★,并自发形成纤维斑块和复合斑块,动脉受损严重程度方面有类人的特征,且雄性高于雌性,故本实验选用雄性 LDLR −/− 小鼠 [20] 。研究表明, LDLR−/− 小鼠以高脂饲料饮食饲养, 12 周左右即可于小鼠主动脉弓部发现广泛的 AS 斑块 [21] ■★◆★。阿托伐他汀钙是一种强效的降胆固醇药物,具有抑制炎症细胞和炎症介质释放、抑制血栓形成、保持斑块稳定等作用,因此选用阿托伐他汀作为阳性对照药物 [22] 。血脂水平与 AS 病变程度密切相关,因脂质异常会造成血液黏度上升,其可附着于血小板与红细胞表面,增加细胞间黏附性★◆■,而红细胞聚集性增加■★,则导致血流缓慢,引起主动脉根部脂质积聚,炎性细胞汇聚,从而诱发炎症的发生■◆,加速 AS 的形成。本研究结果显示■◆,不同剂量的茱萸丸均能不同程度地降低 AS 模型小鼠血清中 TC 、 TG 、 LDL-C 含量,升高 HDL-C 含量,并有效减少脂质堆积■■◆。本研究组织病理学结果也佐证了此结论,茱萸丸干预后,可有效减轻模型小鼠主动脉的粥样斑块沉积★◆■■★,并增加斑块的结构韧性,降低易损性★■◆■■,增加胶原防止弹性纤维进一步被破坏,保护中膜结构,且与药物剂量成正相关关系★◆★★★,以高剂量茱萸丸的总体效果最好。脂质代谢功能的下降可诱导机体氧化和抗氧化能力失衡★★★■, SOD 活性下降, ROS 含量增高,导致血管内皮下间隙的脂质和脂蛋白被氧化形成低密度脂蛋白,并影响血管壁正常结构及功能而加快 AS 发展 [23] 。本研究结果显示■◆★■◆◆,茱萸丸干预后小鼠血清 ROS 水平显著降低★■◆★★■, SOD 活性显著升高,提示茱萸丸可减轻氧化应激损伤而抑制 LDLR −/− 小鼠 AS 进展★■★★。
石蜡组织切片经脱蜡◆★★◆■■、水化◆◆■、抗原修复、标记及封闭■◆★★■■,滴加TXNIP 抗体(1 ∶50 ),4 ℃孵育过夜■◆★★;磷酸缓冲液浸洗3 次,滴加荧光二抗(1 ∶100 ,滴加CY3-TSA )◆◆★■★★,湿盒中37 ℃孵育1 h ■◆,PBST 浸洗3 次◆■■,血清室温封闭30 min ■◆◆★■,吸掉封闭液■★★,滴加稀释的NLRP3 抗体(1 ∶50 ),4 ℃孵育避光过夜,PBST 浸洗3 次■★◆■,滴加荧光二抗(1 ∶100 ,FITC-TSA ),湿盒中37 ℃孵育1 h ,PBST 浸洗3 次,滴加DAPI 避光孵育5 min 复染细胞核,PBST 浸洗4 次去处多余的DAPI ,用含抗荧光淬灭剂的封片液封片■■◆,荧光显微镜下观察并拍照记录,采用Image pro plus 6.0 软件进行分析。
称取50 g 黄连★★■◆★、50 g 吴茱萸后,加入10 倍量水浸泡1 h ,然后煎煮40 min 滤过,滤渣加入9 倍量水继续煎煮30 min ,合并2 次滤液后放入真空冻干机中制作冻干粉。最终100 g 茱萸丸获得17.21 g 冻干粉,即每克冻干粉中含5.81 g 药材,保存于4 ℃备用。采用高效液相色谱仪对茱萸丸中小檗碱★◆■■◆★、黄连碱、吴茱萸碱和吴茱萸次碱4 种主要生物碱进行检测 [12] ,结果显示,茱萸丸中含有36■★◆◆.8 mg/g 小檗碱★★、14.9 mg/g 黄连碱、0.78 mg/g 吴茱萸碱和0.33 mg/g 吴茱萸次碱。
将冰冻切片晾干,置于异丙醇浸泡5 min ,油红O 染液孵育10 min ,分化后用苏木素复染2 min ,冲洗★★,少许甘油封片,显微镜下观察和摄片,采用Image pro plus 6★◆◆★★.0 软件分析◆◆★。
取各组主动脉组织◆■■★◆★,按照ROS 试剂盒说明书操作■◆★★◆,激发和发射波长分别为490 、525 nm ◆◆◆★★★,测定ROS 吸光度( A )值★◆■,根据样品和对照相对荧光单位(relative fluorescence unit ,RFU )的差值计算ROS 含量■◆★★★。
茱萸丸由黄连5 g 、吴茱萸5 g 组成。黄连(批号190901 )、吴茱萸(批号191001 )由成都中医药大学附属医院制剂室提供,经成都中医药大学鉴定教研室严铸云教授分别鉴定为毛茛科植物黄连 Coptis chinensis Franch. 的干燥根茎、芸香科植物吴茱萸 Evodia rutaecarpa (Juss★★◆★★.) Benth. 的干燥成熟果实◆★■,符合《中国药典》2020 年版要求。
末次给药后★★◆★◆◆,收集小鼠新鲜粪便。戴一次性无菌手套★★★◆,左手抓住小鼠◆■,右手轻轻柔按揉小鼠腹部,刺激排便■◆★■★。当有粪便排出时,用一次性镊子夹取粪便2 ~3 粒■■★◆■◆,置于灭菌冻存管,液氮保存。每取1 只小鼠粪便换1 次镊子,以防交叉感染,影响肠道菌群结果,且夹取粪便放入冻存管中务必迅速★■◆,以防空气中暴露太久◆★,导致感染★■★◆★◆。小鼠粪便样本送至武汉迈维生物科技有限公司进行16S rRNA 测序★◆◆,按试剂盒说明进行操作。
将采集完血清标本的小鼠脱脊椎处死,剪开胸骨,暴露心脏,1 mL 注射器穿刺左心室注入◆★;磷酸盐缓冲液冲洗主动脉后完整分离◆■★,在冰上剪段,用4% 多聚甲醛固定、最佳切削温度(optimum cutting temperature ,OCT )包埋剂处理■■■■◆◆,制成厚度为5 μm 的石蜡切片■★,进行常规HE 、Masson 染色,光学显微镜下观察主动脉病理变化并拍照保存★■★■★★。
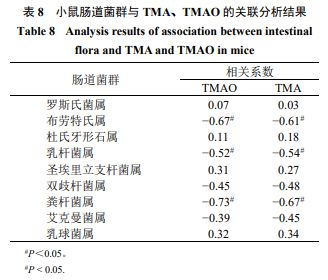
如表8 所示,布劳特氏属、乳杆菌属★★■、粪杆菌属与TMA 、TMAO 呈负相关( P <0★★.05 )。
中医学认为◆★◆★■,中焦气机升降失司,脾不散津★◆,津液代谢紊乱★■◆◆★★,聚湿生痰◆■,日久生瘀,痰瘀互结阻于脉道◆★■■◆,导致AS 发生 [7] ★■★★◆。因此,升清降浊★★★■、恢复中焦升降功能,是调控血脂、防治AS 的关键。茱萸丸出自《太平圣惠方》,方中黄连、吴茱萸等比配伍,黄连味苦而性寒,吴茱萸味辛苦而性热,二者苦辛相合,具有苦辛化浊的功效 [8] ★★。课题组前期研究证实◆★,黄连、吴茱萸配伍可显著调控高脂模型动物血脂,且1∶1 调血脂效果最佳 [9] ◆◆★◆,同时可通过巨噬细胞极化、影响脂代谢相关基因发挥抗炎效应 [10-11] 。为进一步探讨茱萸丸防治AS 的作用机制★■,本研究以TMAO 介导的ROS/TXNIP/NLRP3 信号通路为切入点,探讨其减轻内皮细胞损伤的机制,为临床治疗AS 提供新思路。
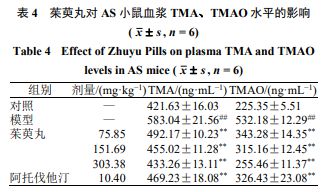
如表4 所示,与对照组比较,模型组小鼠血浆TMA 、TMAO 水平显著升高( P <0■★◆★.01 );与模型组比较,各给药组血浆TMA 、TMAO 水平显著降低( P <0.01 )。
采用SPSS 24.0 软件对数据进行统计分析。计量资料以 表示,先进行正态分析和方差齐性检验■■★■◆◆,若二者均符合,组间比较采用单因素方差(One-way ANOVA )分析;若不符合正态分布或方差齐性检验,采用非参数秩和检验,相关性采用Pearson 相关性分析■★★。
如表2 所示★◆★■■,与对照组比较■★,模型组小鼠血清TG 、TC 、LDL-C 水平显著升高( P <0.01 ),HDL-C 水平显著降低( P <0.01 );与模型组比较◆★■◆★,各给药组小鼠血清TG ■■★、TC 、LDL-C 水平显著降低( P <0.05 ◆■★■★、0.01 )★★■,HDL-C 水平显著升高( P <0.01 )■◆■。
细胞焦亡是近年来发现的一种新型的促炎细胞程序性死亡方式, AS 各阶段均存在血管壁细胞焦亡,其关键步骤是炎症小体的活化 [33] 。 NLRP3 炎症小体是一种与慢性低度炎症反应相关的大分子复合物◆★,主要由 NLRP3 、 ASC 和 Caspase-1 组成 [34] ★◆★。其中 NLRP3 作为一个蛋白复合体的支架, ASC 是 NLRP3 和 Caspase-1 之间的连接体,并参与 Caspase-1 的活化 [35] 。 NLRP3 炎症小体作为炎症和氧化应激通路的上游调控因子◆■■■,是炎症 - 免疫的桥梁,参与了机体众多炎症性疾病的发生、发展过程 [36] 。正常情况下★★★, NLRP3 处于活性抑制状态,当机体受到微生物产物、内源性分子等刺激后,通过 ACS 衔接 Caspase-1 前体被激活■◆■■■◆,并介导 NLRP3 激活 Caspase-1 。 Caspase-1 作为炎症的主要介导者■■◆,其被激活后募集、激活其他免疫细胞,切割 pro-IL-18 、 pro-IL-1β 等前体■◆◆★,使前体转化为活性形式的促炎因子 IL-1β 、 IL-18 等,激活下游炎性通路,产生炎症级联反应★★■。因此■★★◆★★,抑制 NLRP3 炎性小体相关通路◆★◆,能够抑制下游炎性通路的级联放大,从而改善相关炎症性疾病的进展及预后。 IL-18 、 IL-1β 均是 NLRP3 炎性小体活化后产生的主要促炎分子,在 NLRP3 炎性小体通路被激活后表达均增加。本实验中模型组较对照组 NLRP3 ■◆、 ASC ■◆★、 Caspase-1 的蛋白及 mRNA 的表达量显著上升,通路中促炎因子 IL-18 、 IL-1β 水平显著增加,说明 NLRP3 炎症小体处于激活状态★■◆◆◆★。茱萸丸使 NLRP3 、 ASC 、 Caspase-1 的蛋白及 mRNA 表达显著下降★■★,促炎因子 IL-18 ■★◆、 IL-1β 水平明显下降★■★,说明 NLRP3 炎症小体受到抑制◆★。 TXNIP 是氧化应激与 NLRP3 炎症小体之间的桥梁,作为激活 NLRP3 炎症小体的物质不可或缺 [35] ★◆。在 ROS 的作用下◆★, TXNIP 从细胞核中释放出来,并与胞质中的 TRX1 和线 结合,导致 ROS 水平升高■■★◆。增加 ROS 可以氧化 TRX1 ■■★,而氧化形式的 TRX 不能与 TXNIP 结合,使 TXNIP 成游离状态 [36] 。游离的 TXNIP 能直接与 NLRP3 结合,从而激活 NLRP3 炎症小体。因此, TXNIP 可以直接结合 NLRP3 或通过产生 ROS 间接激活 NLRP3 炎症小体。本研究结果显示,茱萸丸能有效降低 ROS 水平以及 TRX 、 TXNIP ■★★◆、 NLRP3 、 ASC 、 Caspase-1 的蛋白和 mRNA 表达,提示茱萸丸在改善 TMAO 激活的 ROS/TXNIP/NLRP3 通路及下游的炎症方面均有一定的效果。
目前 TMA/TMAO 的代谢途径受到广泛关注■★★◆★★,被认为是 AS 的潜在促进剂。 TMAO 是胆碱、卵磷脂和肉碱的代谢产物◆★◆■◆,可由 TMA 转变而来 [24] 。肠道中的膳食胆碱和左旋肉碱在多种酶的作用下产生 TMA ★◆,后者在肠道上皮细胞被吸收并输送到肝脏,在肝脏中被黄素单加氧酶 3 进一步氧化◆■,形成 TMAO , TMAO 通过诱发炎症 [25] 、促进泡沫细胞形成 [26] 及调控胆固醇的转运和代谢 [27] 进而促进 AS 的发生发展■★。 Meta 分析结果亦显示■★,循环 TMAO 水平越高,心血管事件的发生率越高 [28] 。因此,抑制肠道菌群代谢产物 TMA ,进而减少 TMA 向 TMAO 的转化,可能是防治 AS 的有效途径★★★■■。本研究发现,茱萸丸干预能够显著降低 LDLR −/− 小鼠血浆 TMA 和 TMAO 水平■■,从而发挥抗 AS 的作用◆★■★。经 16S rRNA 技术分析肠道菌群的结构◆◆■■■、多样性变化发现, Alpha 多样性指数变化提示肠道菌群多样性可因 AS 发病而降低,因茱萸丸干预而提高。 AS 常伴随厚壁菌门丰度降低以及拟杆菌门丰度上升■★,并且两者比值 F/B 的高低,多用于肠道菌群失调程度的评估 [29] 。本研究发现★★◆◆,门水平上厚壁菌门、拟杆菌门为优势菌群。模型组厚壁菌门相对丰度增加,拟杆菌门相对丰度减少, F/B 值呈现升高趋势,这表明 AS 小鼠肠道菌群门水平物种比例失衡,菌群紊乱态势明显◆■★■■★,与文献所载相似 [30] 。而茱萸丸干预后小鼠肠道厚壁菌门相对丰度减少,拟杆菌门相对丰度增加, F/B 值出现回调趋势,肠道紊乱被纠正◆★■。属水平上布劳特氏属■★◆■、粪杆菌属、乳杆菌属菌群丰度上升。其中布劳特氏菌属的发酵产物■◆★◆■◆,如乙酸、丙酸和丁酸等具有优良的抗炎、调血脂活性★◆,对 AS 具有良好的预防和治疗作用。研究表明■■,粪杆菌属在 AS 患者粪便中富集,提示粪杆菌属可能为 AS 的致病菌之一 [31] ◆★■★■■。乳杆菌属为肠道内有益菌群◆■★◆■★,其可激活调节性 T 细胞■■■★◆,抑制辅助性 T 细胞◆■◆★★,影响巨噬细胞亚群比例◆◆★■,进而调节免疫,抑制 AS 相关炎症 [32] 。本研究发现◆★,布劳特氏菌属、粪杆菌属、乳杆菌属与 TMA ◆■■■◆◆、 TMAO 呈显著负相关。因此,茱萸丸可能通过提高布劳特氏菌属◆◆★★■、粪杆菌属以及乳杆菌属相对丰度,抑制 TMA 生成,进而减少 TMAO 生成发挥抗 AS 的作用。
SPF 级雄性 C57BL/6J 小鼠 13 只,同品系的低密度脂蛋白受体敲除( low density lipoprotein receptor knockout ■■, LDLR −/− )小鼠 53 只,体质量 (22 ±2 )g ,6 周龄★◆★,购自成都达硕实验动物有限公司★■◆◆★,动物合格证号SCXK (川)2020-034 。动物饲养于成都中医药大学动物中心清洁级动物房,使用许可证编号SYXK (川)2019-049 ,温度22 ~25 ℃,相对湿度50% ~70% ■■,12 h 明暗循环,自由饮水进食★■。喂养小鼠的基础饲料及高脂饲料均购自江苏协同医药生物工程有限责任公司,合格证号SCXK (苏)2020-0018 ★◆。高脂饲料由78.85% 基础饲料、21% 脂肪★■★■★■、0◆■◆.15% 胆固醇构成■◆,所有饲料均经 60Coγ 射线辐照灭菌处理。动物实验通过成都中医药大学动物实验伦理委员会审查(伦理编号2021DL-001 )。
综上,茱萸丸可能通过调节肠道菌群中有益菌和有害菌的相对丰度■★◆★,纠正菌群紊乱情况,减少TMAO 合成,抑制ROS/TXNIP/NLRP3 信号通路,减轻下游炎症反应,发挥抗AS 作用(图4 )。鉴于 保护血管内皮在延缓AS发展中的重要作用,有必要进一步开展干扰因素较少的体外研究,以进一步说明茱萸丸对TMAO刺激下血管内皮的保护作用及其机制。
经过适应性喂养后,13 只C57BL/6J 小鼠作为对照组,继续以基础饲料喂养。53 只同品系的LDLR −/− 小鼠给予高脂饲料喂养造模,每天2 次投喂(8: 00 、16: 00 时各1 次),自由饮水及活动12 周,构建AS 模型 [13] ■◆★。造模周期12 周,然后在对照组及造模组中各随机选取3 只小鼠进行主动脉根部油红染色判断造型是否成功◆■◆★,主动脉斑块形成可判定为AS 造模成功 [14] 。造模成功后,将50 只LDLR −/− 小鼠按体质量随机分为模型组及茱萸丸低、中、高剂量(130★■★◆.54 、261◆★★■■■.08 、522.16 mg/kg ,分别相当于临床剂量的0.5 、1 、2 倍 [15] )组和阿托伐他汀(10■◆★★◆.40 mg/kg )组★■◆,每组10 只◆★◆。各给药组ig 相应药物,对照组和模型组ig 等体积无菌蒸馏水■◆◆,1 次/d ■◆,连续给药12 周。
按照试剂盒说明书检测血清中IL-18 、IL-1β ★■◆■、ROS 水平和SOD 活性。
3.5◆■■■.3 属水平菌群丰度及差异 如表7 所示,与对照组比较,模型组粪杆菌属、布劳特氏属、乳杆菌属菌群丰度显著下降( P <0.01 )★◆■◆■◆;与模型组比较,各给药组布劳特氏属■★◆★、乳杆菌属菌群丰度显著升高( P <0■★.01 ),茱萸丸中★■■■、高剂量组粪杆菌属丰度显著升高( P <0.01 )。
如图2 、表10 和图3 、表11 所示,与对照组比较,模型组小鼠主动脉组织TXNIP ■★★★■◆、NLRP3 蛋白表达水平显著升高( P <0.01 )◆◆◆★;与模型组比较,各给药组TXNIP 、NLRP3 蛋白表达水平明显降低( P <0.01 )■■◆★。